Acide dithionique
| Acide dithionique | |
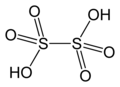  Structure de l'acide dithionique |
|
| Identification | |
|---|---|
| Synonymes |
acide hypodisulfurique |
| No CAS | |
| PubChem | 26985 |
| ChEBI | 29208 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2O6S2 [Isomères] |
| Masse molaire[1] | 162,142 ± 0,012 g/mol H 1,24 %, O 59,21 %, S 39,55 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L’acide dithionique, ou acide hypodisulfurique, est un composé chimique de formule H2S2O6. C'est un oxoacide de soufre connu exclusivement en solution[2].
Sels
[modifier | modifier le code]L'ion dithionate S2O62− est dibasique et forme des sels appelés dithionates très solubles dans l'eau. Ce sont des oxydants et des réducteurs doux. Leur structure ressemble à celle de l'éthane mais avec une conformation quasiment éclipsée et une longueur S–S de 215 pm (les liaisons S–O ont une longueur de 143 pm).
Synthèse
[modifier | modifier le code]Les dithionates peuvent être préparés au laboratoire par oxydation de sulfites (passage de l'état d'oxydation +4 à +5) mais sont produits à plus grande échelle en oxydant une solution aqueuse froide de dioxyde de soufre SO2 en présence de dioxyde de manganèse MnO2 :
La solution de dithionate de manganèse MnS2O6 obtenue peut ensuite être convertie en d'autres dithionates métalliques par métathèse. On peut alors obtenir des solutions concentrées d'acide dithionique H2S2O6 en traitant des solutions de dithionate de baryum BaS2O6 à l'acide sulfurique H2SO4 :
- BaS2O6 (aq) + H2SO4 (aq) → H2S2O6 (aq) + BaSO4 (s) ↓.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Norman N. Greenwood, Alan Earnshaw, « Chemistry of the Elements », 2e édition, pp. 715-716, Butterworth-Heinemann, Oxford, 1997. (ISBN 0080379419).
